冷冻电镜结合Nanodisc在膜蛋白研究的应用
细胞生物膜所含的蛋白称为膜蛋白,其参与和行使了众多细胞功能,包括细胞与外界进行物质运输、信息传递、能量交换等。膜蛋白担任了各种神经信号分子、激素和其他底物的受体,构成了各种离子跨膜的通道,以及构成各类转运蛋白。在人体蛋白中,有大约 30% 是膜蛋白。FDA 批准的新药中,大多数都以膜蛋白为靶点。
随着对膜蛋白工作机理的深入研究,新的细胞调控作用靶点不断被发现,从而使作用于靶点的新药能更有针对性地被开发出。例如现在市面上有不少基于细胞转运通道蛋白设计的药物,常见的一类抗高血压药(如氨氯地平),其主要功能是钙离子通道阻滞剂,选择性的同离子通道结合以阻滞钙离子进入细胞,从而导致心肌收缩力减弱、心率减慢和血管扩张等以达到降压的作用。膜蛋白结构是设计并开发靶向作用于膜蛋白药物的重要依据,但目前已被研究清楚结构的膜蛋白仅占膜蛋白总量的 1%。这是因为膜蛋白依附或横跨在细胞膜的磷脂双分子层上,所以膜蛋白的纯化、结构的解析等都极具挑战性。
对蛋白包括膜蛋白结构的解析和研究是蛋白研究的基础, X 射线晶体学、核磁共振(NMR)和冷冻电镜(Cryo-EM)被称作结构生物学研究的三大利器,在现今已解析的膜蛋白结构中,90% 以上都采用的是 X 射线晶体学方法,而核磁共振在小分子量的蛋白结构解析中发挥了重要的作用。数十年里,X-射线晶体学一直是解析蛋白质结构的首选方法。然而 X 射线晶体学方法对样品要求很高,需要得到具有衍射能力的蛋白晶体。但许多的蛋白质,尤其是膜蛋白和蛋白质复合物却难以结晶。而另一方面,NMR 可用来解析较小的蛋白的结构(一般不超过 30 kDa),但较难用于分子量较大蛋白的结构解析。在之前的很长时间里,冷冻电镜由于其解析结构的分辨率较低,一直未能得到广泛的应用。近年来,冷冻电镜领域里硬件和算法的突破性进展使得现在能够利用 cryo-EM 解析近原子分辨率的结构,及大地促进了结构生物学的发展。
不同于晶体学,cryo-EM 所需的样品量很少、无需生成晶体而只需保持水溶液环境下稳定。在 2013 年末,美国加州大学旧金山分校的程亦凡教授与同事 David Julius 合作,利用单电子计数探测器,以近原子分辨率 (3.4 Å),确定了在疼痛和热知觉中起中心作用的一种膜蛋白 TRPV1 的结构。这一研究成果让相关领域工作者开始重新审视冷冻电镜在结构生物学研究中的所能发挥的作用。这对于一些难结晶的蛋白质,特别是膜蛋白的结构生物学研究提供新的契机。随着不断的尝试,利用冷冻电镜对膜蛋白结构解析的成果也越来越多,作为药物研发方面的应用,要分析小分子与蛋白质的互作,而且分辨率越高越好。现在 Subramaniam 等人达到了 cryo-EM 成像迄今为止的高分辨率(2.2 Å),此前只有 X 射线晶体衍射达到过这种水平的分辨率,这能为人们提供足够的结构信息,进行更好的药物研发。

图 1:分辨率对观测结果的影响(左)不同分辨率对应能测定的分子结构(右)(图片来源:Elad Binshtein, Melanie D. Biochemistry, 2015)
膜蛋白基本可分为三大类:整合膜蛋白、外周膜蛋白和脂锚定蛋白。整合膜蛋白占膜蛋白种类的 70%~80%。外周膜蛋白一般为水溶性,相对容易分离和纯化,也较易获得结晶供 X 射线衍射分析。难于研究的是整合膜蛋白,由于其具有疏水的跨膜区域,因此直接暴露在水溶液环境下非常不稳定,因此需要添加去污剂进行稳定。而当用去污剂保护膜蛋白进行结构解析和功能研究时,又会因为膜蛋白离开其天然磷脂双分子而丢失有关脂质互作及它们对蛋白结构影响这一层重要信息。这尤其对需要脂质起结构和调节作用的蛋白质有较大影响。另外,不合适的去污剂会使膜蛋白不稳定,且去污剂胶束与磷脂分子的结构差异及水脂界面弯曲度在某些情况下可能造成膜蛋白结构的改变。
为了更好地让膜蛋白能够稳定在水溶液环境下通过冷冻电镜进行结构解析,且避免去污剂会带来的潜在影响,作为模拟细胞膜磷脂双分子层结构的 Nanodisc 是确保实验结果不受各种不确定因素影响的解决方案。Nanodisc 起初由 UIUC 的 Stephen Sligar 教授提出,其由膜支架蛋白 (membrane scaffold proteins, MSPs) 和磷脂分子构成的磷脂双分子层类膜结构。Nanodisc 的理化性质与细胞膜磷脂双分子层相似,且膜蛋白可以整合到 Nanodisc 中,极大范围地保持其结构稳定和生物学活性,为膜蛋白的研究提供了有力的技术支持。膜支架蛋白(MSPs) 是载脂蛋白(apo)A-I 的缩减版,它们包绕着脂质双分子层从而形成圆盘状的结构,即 Nanodisc。其包含一个朝向内部脂层的疏水面和朝外的亲水面。这一结构使得 Nanodisc 在水溶液中具有很高的溶解度,同时具有非常高的稳定性。通过 Nanodisc 包裹,纯化后的膜蛋白在保持空间结构稳定和活性的同时,也将模拟膜蛋白原有在细胞膜上的状态,跨膜域被包埋在磷脂双分子层内部。
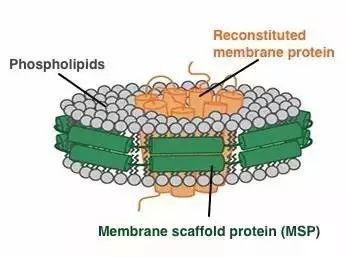
图2:膜蛋白组装到Nanodiscs的原理图。绿色:膜支架蛋白(MSPs);灰色:磷脂;橙色:膜蛋白(图片来源Cube Biotech官方网站)
将膜蛋白组装到Nanodiscs中主要有两种方法:
第一:组装溶解在去污剂中的膜蛋白在去污剂存在条件下将膜蛋白纯化,然后再添加MSPs和磷脂。含有膜蛋白的Nanodiscs能够自发地组装,在去除掉表面活性剂后可以通过凝胶过滤(排阻层析)等方式来纯化。
第二:Nanodiscs与无细胞表达体系相结合,针对于一些特殊蛋白,例如带有毒性的蛋白可通过无细胞表达体系表达,通过加入已经预先组装的Nanodiscs使表达出的膜蛋白通过自组装镶嵌进去。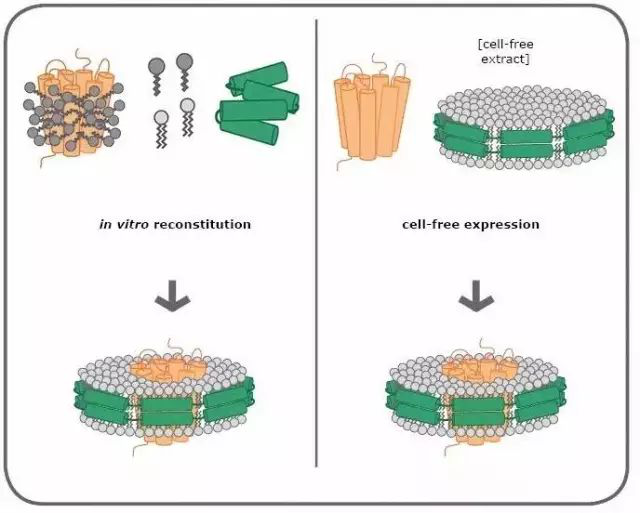
图3:膜蛋白与Nanodisc的两种组装机制(图片来源Cube Biotech官方网站)
左图:膜蛋白(橙色)溶解在去污剂(深灰色)中并与冻干的MSP(绿色)和磷脂(浅灰)混合。然后去除去污剂,形成蛋白-Nanodisc复合物。
右图:预组装了MSP与磷脂的Nanodisc加入到无细胞反应液(cell-free expression systems)中,新生的膜蛋白能够自发地组装到Nanodisc中。
结合Nanodisc和冷冻电镜这两项技术,越来越多的膜蛋白结构得以解析。其中较有代表性的包括程亦凡教授通过阐明Nanodisc中TRPA1的结构解释了配体和脂质的作用机制,确定了环状脂质和调节脂质的定位,证实通过形成一种三元复合物,特异的磷脂互作促进了一种蜘蛛毒素等相关配体结合TRPV1,相关成果发表在2016年Nature上。此外由于Nanodisc还可以实现在同一个Nanodisc上实现寡聚、二聚和单体的镶嵌,来自欧洲的Rouslan G及其合作者在Nanodisc上镶嵌ryanodine受体四聚体使用冷冻电镜实现了结构解析,相关成果也发表在2015年Nature杂志上。相信伴随着冷冻电镜解析能力的不断提升,以及如Nanodisc稳定膜蛋白和还原膜蛋白天然环境技术的不断出现,膜蛋白结构解析和功能研究将会迎来全新的发展。
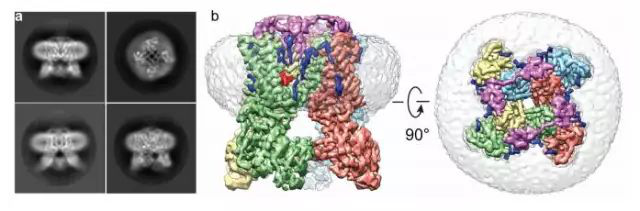
图4:通过冷冻电镜解析Nanodisc包裹TRPA1蛋白结构,b、c灰色部分为Nanodisc(图片来源于程亦凡2016 Nature 文章)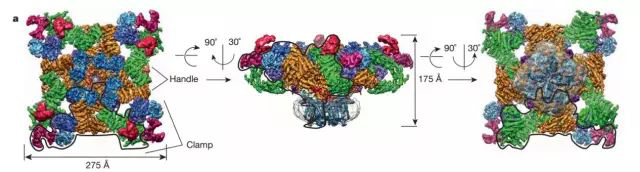
图5:通过冷冻电镜解析Nanodis 包裹ryanodine受体四聚体结构,灰色部分为Nanodisc(图片来源于RouslanG 2015 Nature 文章)
参考文献:
1. Yifan Cheng , et al. A Primerto Single-ParticleCryo-Electron Microscopy. 161(3):438 (2015).
2. Elad Binshtein, Melanie D. OhiCryo-Electron Microscopy and theAmazing Race to Atomic Resolution [J].Biochemistry, 54: 3133-3141 (2015).
3. Yifan Cheng , et al. Single-particleelectron cryomicroscopy. Nature Methods 11, 30 (2014).
4. Li, X. et al. Electron countingand beam-induced motion correction enablenear-atomic-resolution single-particlecryo-EM. Nature Methods 10, 584–590(2013)
5. Bayburt, T.H., Grinkova, Y.V.& Sligar, S.G. Self-assembly of discoidal phospholipid bilayer nanoparticleswith membrane scaffold proteins. Nano Lett. 2, 853–856 (2002).
6. Bartesaghi A, Merk A, BanerjeeS, Matthies D, Wu X, Milne JL, Subramaniam S. Electron microscopy. 2.2 Åresolution cryo-EM structure of β-galactosidase in complex with a cell-permeantinhibitor. Science. 5;348(6239):1147-51 (2015).
7. Sun L, Zhang X, Gao S, Rao PA,Padilla-Sanchez V, Chen Z, Sun S, Xiang Y, Subramaniam S, Rao VB, Rossmann MG.Cryo-EM structure of the bacteriophage T4 portal protein assembly atnear-atomic resolution. Nat Commun. 6;6:7548 (2015).
8. Ilia G Denisov,Sligar, S.G. Nanodiscsfor structural and functional studies of membrane proteins. Nature Structural &Molecular Biology23,481–486(2016)
9. Rouslan G. E, et al. Architecture and conformationalswitchmechanism of the ryanodine receptor. Nature 517. 39 (2015).
10. Lagers tröm, M.C. et al.Structural diversity of Gprotein-coupled receptors and significance for drugdiscovery. Nature Reviews Drug Discovery 7, 339-357 (2008).
11. Hagn, F. et al. Optimizedphospholipid bilayer Nanodiscs facilitate high-resolution structuredetermination of membrane proteins. J.Am.Chem. Soc., 135:1919-1925(2013).
12. Wang, Z. et al. Tyrosinephosphorylation of Mig6 reduces its inhibition of the epidermal growth factorreceptor. ACS Chem. Biol. 8(11):2372-6, (2013).
13. Timothy H. B, et al. TransducinActivation by Nanoscale Lipid Bilayers ContainingOne and Two Rhodopsins. JOURNALOF BIOLOGICAL CHEMISTRY. 282 (2007).
14. Krueger-K, et al. An evaluationof detergents for NMR structural studies of membrane Proteion. J Biomol NMR,28(1) 43-57 (2004).
15. Yoshiura C, et al. NMR analysesof the interaction between CCR5 and its ligand using functionalreconstitutionof CCR5 in lipid bilayers. J Am Chem Soc, 132 (19): 6 768-6 777 (2010).
16. Erik Henrich, et al. Analyzingnative membrane proteinassembly in nanodiscs by combined noncovalent massspectrometry and syntheticbiology. eLife6:e20954 (2017).
17. Moers et al., Modified lipidand protein dynamics in Nanodiscs. Biochim. Biophys. Acta, 1828(4):1222-9, (2013).
18. Nasr. et al., Radioligandbinding to Nanodisc-reconstituted membrane transporters assessed by thescintillation proximity assay. Biochemistry, 14;53(1):4-6, (2014).
19. 毕允晨,王玉娟,王俊峰.Nanodisc体系在膜蛋白结构与功能研究中的应用。 《波谱学杂志》, 28(2):177-189(2011)
20. 张凯.什么是2015年最受科学界关注的新技术?知乎专栏,(2016)
21. 程亦凡博士Nature发表突破性成果.生物通.(2016)
22. Nature Methods公布2015年度技术-生物通,(2016)










 Home
Home Facebook
Facebook WeChat
WeChat Twiitter
Twiitter
